冠状病毒药物研发与技术情报专辑——冠状病毒的研究现状
2019年新型冠状病毒感染的肺炎疫情爆发后,引 起国际社会高度重视。本文对Cortellis药物研发综 合情报平台的冠状病毒综述报告《Disease Briefing: Coronaviruses》(2020年1月30日)重要内容进行摘 编,旨在通过全面梳理冠状病毒的诊断、预防和治 疗的研究进展,为当前疫情的科学研究提供参考。
冠状病毒是一组有包膜的正义单链RNA病毒,属巢 病毒目(Nidovirales)、冠状病毒科、冠状病毒亚科,已 知26种[5],并根据不同的抗原交叉反应和遗传组成 被分为4个属(α、β、γ和δ),其中只有α-和β-属含有 对人致病的毒株[6]。
全球第一例已知冠状病毒为禽传染性支气管炎病 毒,于1937年被分离出来,是引发鸡群重度感染的 病原体;第一例人冠状病毒于1965年由Tyrrell和 Bynoe从人类鼻腔中分离出来,体外扩增结果显
示,该病毒已在人类中存在至少500-800年,起源于 蝙蝠[7, 8]。
长期以来,冠状病毒作为重要的动物病原体,可引 发哺乳动物和鸟类的呼吸道及肠道疾病。已知冠状 病毒中,有6种可引发人类疾病,包括:HCoV-229E、 HCoV-OC43、HCoV-NL63、HCoV-HKU1、SARS-CoV和 MERS-CoV[9, 10]。其中,前4种为局部流行性疾病,主 要引起轻度自限性疾病,而后两种可引发重症[11]。 2002年和2012年发现的SARS-CoV和MERS-CoV属于 β-冠状病毒[12],并由于其对人类的高威胁性被列入 WHO高威胁清单[13]。冠状病毒引发的高患病率对人 类健康构成持续威胁[2]。2019年底在中国武汉爆发 的大规模呼吸系统疾病中分离得到的2019-nCoV, 成为第七个能够引发人类疾病的离散冠状病毒种 属,表征为β-冠状病毒[14, 15]。


图1 数字彩色透射电子显微镜(TEM)图像 图片来源:疾控中心/ Fred Murphy; Sylvia Whitfield
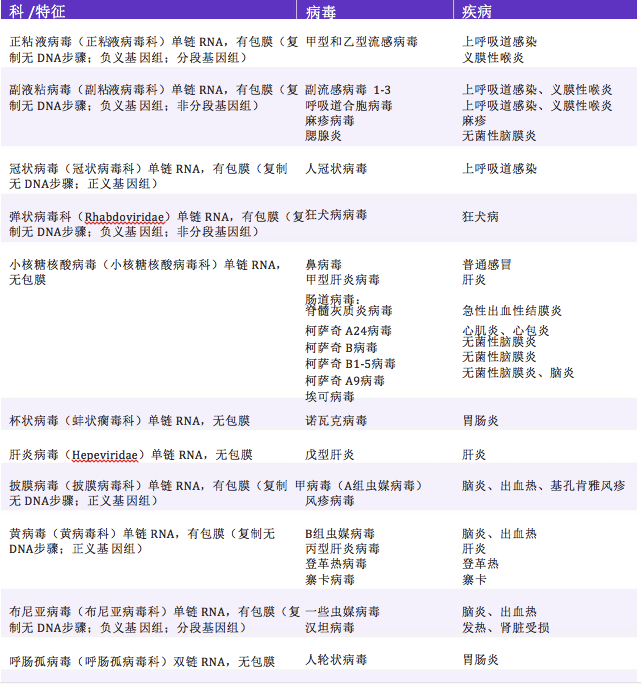
表 1 重要的RNA病毒列表

1. 形态学、结构和复制
“冠状病毒”因其在电子显微镜下呈现的标志性冠 状结构而得名,该结构为S糖蛋白在病毒包膜表面 形成的辐射状刺突[16]。
微观结构显示,冠状病毒包含两种主要的包膜蛋 白:S糖蛋白和M蛋白。前者是受体结合和细胞融合 的主要抗原[17],后者参与出芽和包膜形成过程,并 在病毒颗粒组装中发挥关键作用[18]。少数冠状病毒 具 有 第 三 种 糖 蛋 白 ⸺ 血 凝 素 酯 酶 [ H E ] 。此 外 ,病 毒衣壳内的碱性磷蛋白[N]与病毒基因组有密切关 系。冠状病毒的基因组是非片段正义单链RNA,约 26-32kb,是已知最长的RNA病毒基因组,含有7-10个 不同的开放阅读框(ORF)。基因组RNA5’端具有甲 基化帽,3’端具有poly-A尾[17, 19]。
冠状病毒的高致病性依赖于其灵活的基因重组 和快速的适应性突变。一方面,单链RNA在复制 过程中使用的RdRP(RNA依赖性RNA聚合酶)具有 1,000,000个突变/位点/复制的固有错误率,可导致 连续点突变;另一方面,当两种冠状病毒共同感染 同一宿主时,可从对方的基因组中获得数百或数千 碱基对的基因组片段,以增加自身生态位点,或成 为新病毒[7, 20, 21],导致了冠状病毒在约二十年内迅 速变异出三种极具流行潜力的新型人类冠状病毒: SARS-CoV、MERS-CoV和2019-nCoV。
2. 流行病学、发病率和死亡率
冠状病毒可引发人类轻度、自限性上呼吸道感染, 如普通感冒(15%-30%)[16]和肺炎,也可引发人类 胃肠炎以及其它动物疾病[8, 22]。
在巴西圣保罗进行的一项为期9年的综合流行病 学研究显示,在1137个样本(包括无症状个体、普 通患者、并发症患者和重症患者)中,7.7%的呼吸
道样本检测到人类冠状病毒,其中,NL63(50.0%) 和OC43(27.3%)是最常检测到的冠状病毒,不同 年份的流行病毒存在差异(如在2004年,HCoV- 229E是流行的主要病毒株(61.5%))[23]。
2014年,对中国北京的559份成人急性呼吸道感染 采样研究表明,HCoV-OC43的检出率为12.5%,且在 秋季达到峰值[24]。
同年,对西班牙马略卡686例急性呼吸道感染成人患 者(2013年1月至2014年2月)的分析显示,21.6%的患 者与病毒感染有关,其中,7%由冠状病毒引起,常见 致病菌株为OC43(50.0%)、NL63(29%)和229E(21%)。 研究表明,52%的CoV感染患者需要住院治疗,2例患 者需要重症监护,尚无致命的CoV感染[25]。
2016年至2017年,一种新发现的冠状病毒在中国造 成近2.5万头仔猪死亡,该病毒出现在SARS-CoV发源 地附近的马蹄蝙蝠身上,与2002年的SARS-CoV为同 一种蝙蝠(Rhinolophus spp)。这种新病毒被命名为 猪急性腹泻综合征冠状病毒(SADS-CoV),尚未证实 能感染人类[26]。
2019年底,一种新型冠状病毒在中国引起发热性呼 吸道疾病。该病毒暂命名为2019-nCoV,首次在武汉 市中心被检测到,并被确定来源于武汉市的一家海鲜市场(目前已关闭)。中国的研究机构迅速展开疫 情防控和科学研究,分离出病毒,并进行测序。结果 显示,2019-nCoV为2B组的β-冠状病毒,与SARS-CoV的基因序列相似性至少为70%[2]。据WHO统计,截至 2020年1月27日,全球共检出2798例2019-nCoV确诊 病例,其中,中国2741例以及5794例疑似病例,泰国、日本、韩国、美国、澳大利亚和越南等国家报告了孤 立病例和旅行相关病例。截至1月26日,中国确定了 至少80例2019-nCoV感染病例死亡。WHO认为该事件在中国的风险评估为非常高,在区域和全球水平 为高[14, 27]。
3. SARS
SARS(Severe acute respiratory syndrome,即严重急 性呼吸综合征,以下简称SARS)是由冠状病毒引起 的呼吸系统疾病,于2002年11月起源于中国广东 省,2003年初在亚洲首次报告,随后在北美和欧洲 报告了类似疾病[28, 29],之后,全球五大洲33个国 家和地区皆有对SARS的报告,其中,中国受影响最大 (香港和北京较严重);2003年春,SARS成为全球健 康威胁。研究表明,全球人口的高度流动与疫情的 快速传播与密切相关[5, 29, 30]。
SARS在全球迅速蔓延引起了高度重视。尽管在 2003-2013年间,SARS再未出现,但专家呼吁,有必 要持续监测该冠状病毒和相关冠状病毒,以确保 病毒再次出现时能够快速应对[31]。各国家/地区高 度重视冠状病毒引发的疫情:SARS之后,中国政府 在公共卫生、传染病监测、应对及报告等方面投入 了大量资金,确保国家能够更有效地应对之后发 生的健康威胁,如H7N9禽流感[32];基于SARS的相 关经验,国际应对2012年爆发的MERS(中东呼吸综 合征)时也更加快速、有效[12, 33, 34];2019年底,随着 COVID-19在中国和全球的出现和迅速传播,相关防 疫经验再次得到应用[2]。
3.1 SARS病毒
SARS的病原体于2003年3月24日由香港以及美国疾 病控制和预防中心首次报告,并得到细胞培养、显 微镜检查、微阵列数据、血清学检测和PCR等多种 证据支持[35]。2003年4月17日,WHO正式宣布该病原 体为冠状病毒家族新发现的成员,命名为“Urbani SARS-associated coronavirus”(简称SARS-CoV)。测序 结果表明,SARS-CoV与已知表征过的冠状病毒仅存 在较远的相关性[8, 36],此前未在人类身上发现。
在病毒溯源的过程中,未发现健康人群中含有SARS-CoV抗体,表明该病毒未曾在人群中传播,很 可能起源于动物,突变后导致人类感染。美国和荷 兰的研究人员通过构建猴感染模型系统,最终证明 了SARS-CoV为病原体[37, 38]。
3.1.1 形态
SARS-CoV病毒颗粒呈球形,平均直径为 78nm。病毒含有螺旋核衣壳,由包膜包围[39],其上覆盖 长约20nm的棒状长包膜粒,具有典型的冠状特征。
3.1.2 结构
SARS-CoV的结构与其它冠状病毒相似, 基因序列为5'端、复制酶[rep]、突刺[S]、包膜[E]、膜 [M]、核衣壳[N]、3'端,两端有短的非翻译区,其他5种 非结构蛋白的序列可能分布于ORF S和N之间。[40]
SARS-CoV的基因组共包含11个ORF,可编码23个成 熟蛋白[41]。其中,两个主要ORF约占基因组的三分 之二,编码两种重要多聚蛋白ORF1a和ORF1b。多聚 蛋白通过蛋白水解裂解产生非结构蛋白,其中最重 要的是RNA依赖性RNA聚合酶(Rep)和ATP酶解旋酶(Hel)。不同的SARS-CoV分离株核苷酸序列仅有个 别位点存在差异[42]。
3.1.3 进入
SARS-CoV和普通冠状病毒类似,通过胞 吞和膜融合进入细胞,受体为ACE2[40, 43]。进入靶细 胞的SARS-CoV可被聚阴离子化合物(该化合物对其 它包膜病毒具有抗病毒活性)抑制,表明SARS-CoV 包膜蛋白可能带有正电荷,能与靶细胞表面硫酸 乙酰肝素蛋白聚糖上的负电荷发生相互作用[44]。同 时,SARS-CoV需要在酸化的内涵体中才能产生有 效 感 染 ,表 明 其 作 用 存 在 p H 依 赖 性 [ 4 5 ] 。病 毒 R N A 在 一个独特的瓶状双层膜小室中完成复制[46]。研究发 现,SARS-CoV感染在体内和培养细胞都可引起超微 结构改变,包括形成双膜囊泡、细胞质中出现核衣 壳包涵体和颗粒[39]。
3.1.4 复制
研究显示,病毒RNA聚合酶起始转录完 整负链,生成mRNA,其亚基因组转录是嵌套的,具 有相同的5’端非翻译区和3’端的poly-A尾。病毒 RNA聚合酶与重复基因间序列(TRS,转录调节序 列)相互作用,允许5’前导序列与每个基因的起始 序列之间连接。目前,病毒的复制机制尚不明确,研 究人员推测可能通过含有反前导序列的亚基因组 大小的负链RNA进行。其他证据显示,在被SARS-CoV 感染的细胞中可观察到含有病毒RNA和蛋白的大 颗粒区域,而在其它冠状病毒感染的细胞中未观察 到,由此推测,这些区域可能是SARS病毒的翻译中 心[39]。
3.1.5 组装
病毒颗粒在高尔基体中装配,在扩张的 囊泡中累积,然后被转运并分泌到细胞表面,通过 胞吐作用释放。
3.1.6 生物学特性
SARS-CoV的生物学特性不同于已 知冠状病毒,主要表现在以下2方面:
1)S蛋白中存在一个短锚点:小ORF的数量和位置不 同;只有一个PLP-蛋白酶;核衣壳蛋白中存在一个 独特的短赖氨酸富集区。这些变异的生物学意义尚 不清楚[42, 47]。
2)对Vero细胞(一种来源于非洲绿猴肾上皮细胞的 细胞系)有嗜热性;与其它在低温下生长的冠状病 毒不同,可在37°C下生长,并可感染下呼吸道[44]。
3)SARS-CoV基因组大小在29705―29751个核苷酸 之间[48]。SARS病毒基因组与之前已知的三组冠状 病毒均不匹配,与冠状病毒229E和OC43仅有较弱 的抗原关系。聚合酶基因与第2组的牛和鼠冠状病 毒密切相关,但也具有第3组禽冠状病毒的一些特 征。SARS-CoV不具有存在于第2组和某些第3组冠状 病毒中的血凝素-酯酶,但具有存在于第3组冠状病 毒中的单一木瓜蛋白水解酶[49]。鉴于此,SARS-CoV 单独划分为第4组[42, 47],与三个已知组在系统发育 上等距。其他研究发现了两种该类病毒:HCoV-NL63 (2004)和HCoV-HKU1(2005),二者均遍布全球,而前者至少已在人群中传播数百年[8, 50, 51]。
3.1.7 起源
早期研究表明,SARS-CoV与牛、鼠肝炎冠 状病毒有关,但测序结果未发现有牛-鼠来源,因此 研究人员推断,SARS-CoV是一种新的未知病原体, 而不起源于已有病毒株[41]。相关研究推测,该病毒 可能来源于冠状病毒的祖先,在越过人类物种屏障 导致SARS之前已自然感染野生动物[7],并由动物与 人类病毒之间重组而产生[7]。通过贝叶斯系统发育 干扰等方法,已证明SARS-CoV基因组在RNA聚合酶 基因内具有重组断点:5'区域与哺乳动物冠状病毒 相关,3'区域与禽冠状病毒相关[52]。
2003年5月,香港科学家报道称在一种罕见的果子 狸(Civettictis civetta)(一种树栖猫)中发现了一种 病毒,与引起SARS的病毒几乎相同。香港大学的袁 国勇指出,这种冠状病毒是从生活在巴基斯坦-印 度尼西亚一带的一种棕榈果子狸的粪便中发现的。 2002年11月,最早出现的SARS病例中就有动物食品 加工售卖经营者和广东省参与准备野味宴会的厨 师。香港大学的研究小组能够从所有25只果子狸中 培养出与SARS-CoV几乎相同的冠状病毒,代表了8 种不同的被检测物种[53]。
另一个研究小组在广东省出售食用活体动物中检 测到了SARS-CoV样病毒。同时,有研究发现喜马拉 雅棕榈果子狸(Paguma幼虫)(Paguma larvata)和浣 熊犬(Nytereutes procyonoides)中也均有该病毒[7]。测序结果显示动物和人病毒之间存在系统发育差 异,随后的研究表明,SARS-CoV在果子狸中的传播 时间并不长,其它物种可能作为天然宿主,如蝙蝠 [28,54-55]。
之后,相关人员对疫区进行了血清学分析,结果显 示,约40%野生动物经销商和20%屠宰从业人员携 带有SARS-CoV抗体。研究人员推测,在SARS爆发前 至少两年,该地区已存在SARS样冠状病毒,且该类 病毒起初在人群中并不具备感染性,可能经过进化 适应后,变成SARS-CoV [8]。
3.2 传播
SARS-CoV可通过飞沫和直接接触传播[56]。病毒在痰 液中的浓度可达到约1亿粒/ml[57],在室温条件下可 在受污染表面和物体上存活长达6天[5]。
导致SARS迅速蔓延的主要因素包括:(1)航空旅行 导致的全球人口高度流动;(2)高密度的城市人口 导致的人类频繁接触[58]。
在疫情爆发期间,医疗机构的发病率高于50%,而 庭传播比例较低(6%-8%)[59, 60]。之后的模拟研究 表明,医生和其他医护人员是医院环境中SARS传播 的主要媒介[5]:一方面,呼吸和雾化支气管扩张剂等的使用可能导致气溶胶的形成和含有病毒的飞沫扩散;另一方面,心肺复苏、支气管镜检查、气管 插管术、吸痰也可能增加病毒传播的风险[5, 61, 62]。而外科口罩、手套和防护服的使用则可有效减少院内 传播[63]。
临床研究显示,病毒载量和传播高峰出现在有临床 症状的第10天左右,此时病情恶化⸺因此,患者 在寻求医学救治时感染性最强[5, 64]。其他研究表明, 病毒的传播可持续13天以上(范围2-60天)[5];此外, 潜伏期患者无感染性[65]。
在 病 毒 传 播 过 程 中 ,“ 超 级 传 播 者 ” 受 到 高 度 关 注 [ 5 , 6 6 ] 。研 究 表 明 ,超 级 传 播 似 乎 与 高 病 毒 滴 度 、气 溶 胶、环境污染以及在医疗环境中与其他人的密切接 触有关[5]。
在医学检测方面,冠状病毒的RNA可以在血清转化 后长期存在,且连续数周可在呼吸道分泌物、血浆 和粪便中检测到[5],因此,采取措施降低医院感染 风险具有重要意义[67]。
3.3 症状和疾病
呼吸道是SARS-CoV的主要侵袭部位。SARS-CoV最常 感染下呼吸道,引发严重的急性病毒性肺炎。WHO 对疑似SARS的病例定义包括高热(>38°C)或在过去 48小时内有发热史;胸部X射线检查显示肺炎的新 浸润;流感样症状(寒战、咳嗽、不适、肌痛)或SARS- CoV暴露史;以及SARS的一项或多项阳性诊断检测 [5]。但SARS最初的症状和临床表现很难与其它常见 的呼吸道感染区分开来,老年人可能没有发热。
对尸检样本和实验感染动物的分析表明,SARS-CoV 感染会影响肺部区域,并可在2型肺细胞中被检测 到[21]。研究指出,SARS-CoV在组织中常引起弥漫性 肺泡损伤、支气管上皮剥脱、纤毛缺失和鳞状上皮 化生,一些病例中也观察到巨细胞浸润、噬血细胞 增多症和肿大的肺泡上皮细胞[68]。感染经过炎症 期或渗出期(特征为透明膜形成、肺细胞增生和水 肿)、增生期和纤维化期[21]。
除了呼吸道感染外,胃肠道[69]、中枢神经系统也出现了感染病例[69, 70]。临床特征显示,SARS症状的出现通常遵循三阶段模式:(1)感染后的第1周,症状通常包括发热和肌痛。这些早期症状可能与直接的病毒细胞病变效应有关,可通过PCR检测到病毒载量的增加;(2)第2周检测到血清转化,随后病毒 [71]; 载量降低 (3)20%的感染患者临床特征为病情恶 化,病毒复制失控。该阶段可能是过度免疫应答触 发免疫病理损伤的结果,而过度免疫应答可能是 SARS引起肺损伤的最终原因[21]。
在SARS疫情爆发期间,患者的临床表现不完全相 同。约100%的成人和儿童出现发热,约一半出现咳 嗽和/或肌痛,只有少数患者有上呼吸道症状;11%- 15%的就诊患者和高达40%-70%的住院患者报告了 腹泻[5, 30];部分患者出现淋巴细胞减少症、白细胞减 少症、血小板减少症;其他患者出现乳酸脱氢酶、天 门冬氨酸氨基转移酶和肌酸激酶等酶水平升高,表 明SARS对某些患者的肝脏产生影响[5, 57]。此外,也有 患者出现急性腹痛等其他症状[72];胸部X射线可检查到肺浸润,主要是细胞因子和趋化因子导致[21]; 40%的感染患者发生呼吸衰竭,需要辅助换气,而90%的患者在首次出现症状后一周内恢复。对特定 人群的研究发现:吸烟者比不吸烟者更需要机械换气[72];老年患者发病率和死亡率较高[73, 74],幼儿群体的感染率和感染强度较低[8],10岁以下儿童发病率 仅为1%[76]。
在致死率方面,24岁以下患者的死亡率<1%[54],60岁 以下患者中上升至约13%,60岁以上患者和发生急 性呼吸窘迫综合征的患者死亡率高达约50%[5, 74]。 据统计,疫情爆发期间的总死亡率约为10%,致死 病例的特征为干扰素刺激异常、持续性趋化因子应 答,以及适应性免疫应答失调[74]。
其他不良临床结果的独立相关因素包括已知的糖 尿病/高血糖症病史[75]、高龄、男性、并发肝炎、入院时中性粒细胞计数高及高水平的乳酸脱氢酶,以及 空气污染和宿主遗传变异[5,54,74]。
在患者预后方面,2007年报道的一项前瞻性研究首 次提供了关于SARS幸存者长期愈后的全面信息。来 自安大略省多伦多市的117名SARS幸存者在出院后 的三个不同时间段(3、6和12个月)接受了体检、肺功 能检测、胸部X射线检查和6min步行试验。结果表明, 大多数SARS幸存者在一年前已从疾病中完全恢复。 但SARS幸存者在患病一年后的总体健康、生命力和 社会功能均低于正常水平,许多患者反映无法恢复 到SARS前的工作水平。在评估期间,心理健康医疗资 源的使用率显著高于正常水平[77]。随后对多伦多22 名长期幸存者的研究确定,在发病后会出现持续长 达20个月的症状,包括肌肉骨骼疼痛、疲乏、抑郁和 睡眠障碍[78]。香港研究人员的一项长期随访还发现, 在随访的第四年,233名SARS幸存者有显著的精神疾 病和持续性疲乏[79];另外一项香港随访研究表明,医务工作者多遭受长期损害[80]。
3.4 流行病学与经济损失
在2002年11月1日至2003年8月7日期间,WHO报告了 全球33个国家共8,422例SARS病例和916例死亡病例 [81]。其中,中国受影响最严重,感人人数超过5,327人(占总感染人数的66%),死亡人数达349人(占总死 亡人数的45%)[32]。流行病学研究估算SARS的平均潜 伏期为6.4天,年轻患者的死亡率为6.8%,60岁以上患 者的死亡率为43%[5],全球病死率为11%[56],各地区之 间存在显著差异[82]。
除了国民健康,SARS流行对经济也产生了重要影响。据估计,全球SARS流行的经济损失约为300亿美元, 东亚的年经济增长率下降1个百分点[83],中国的总经济影响为253亿美元[32],仅北京旅游部门的损失达14 亿美元[84]。
尽管SARS对人类健康和经济造成了重大影响,但回 首整个疫情的防控过程,研究人员、医疗机构和医 疗主管部门之间达成了前所未有的国际合作,并有 效遏制了SARS在全球的快速蔓延 [8, 66, 82]。
4. MERS
MERS(Middle East respiratory syndrome,即中东呼吸 综合征,以下简称MERS)是由新型β冠状病毒MERS- CoV引发的急性呼吸道疾病。2012年9月,WHO报告 了两例由已知的人冠状病毒引起的急性呼吸道疾 病病例,患者出现肾功能衰竭并最终死亡[16, 85]。目 前已知的最早病例可追溯至2012年4月[7]。之后研究 表明,引发该疾病的病毒可能来源于蝙蝠[12],单峰 驼为其中间宿主[86];MERS-CoV与SARS-CoV存在遗传 学差异[87],且与后者不同,其细胞受体为二肽基肽 酶4(DPP4亦名CD26)[88, 89]。在人肺上皮细胞试验中, MERS-CoV可引起不同模式的宿主基因表达反应。由 于该病毒可引起人畜共患疾病并且病死率较高(约 35%),因此在全世界引起广泛关注[89]。WHO已发布 对疑似感染者进行适当护理的中期指南[90, 91]。
4.1 MERS病毒
MERS病毒(以下简称MERS-CoV)是一种有包膜的正义单链RNA病毒,基因组大小为29.9 kb。该病毒是已 发现的第一种可感染人类的β冠状病毒属成员,与蝙蝠冠状病毒(例如HKU4和HKU5)的亲缘关系比与SARS-CoV更接近 。血清流行病学研究未能发现 [16, 92] MERS-CoV在受疫情影响地区的普通人群中引起既 往感染的证据,从而确认这是一种新型病毒[16]。
MERS-CoV的基因组排列为5'-复制酶-结构蛋白(刺 突-包膜-膜-核衣壳)-pol(y A)-3',与其它冠状病毒相 似。该病毒有10个ORF和16个假定的非结构蛋白参 与病毒转录和复制过程[10, 16]。
MERS-CoV通过与肾脏和其它器官中表达的DPP4受 体结合而进入宿主细胞[51],利用宿主蛋白酶进入肺 细胞。furin可激活病毒包膜上的S蛋白,介导膜融合 和病毒进入宿主细胞[92]。与SARS-CoV一样,MERS- CoV能够攻克宿主的天然免疫应答,产生高病毒滴 度,诱导细胞因子失调[10, 21]。
4.2 传播
研究猜测MERS-CoV起源于蝙蝠,但其从蝙蝠传播到 人类宿主的机理最初尚不清楚[51]。研究者首先确定 了其中间宿主为单峰驼[9, 92, 93],同时推测了几种可 能的传播途径:直接接触(特别是幼年骆驼),体液、 处理肉类及/或食用未经巴氏消毒的骆驼奶[12, 94]。 MERS-CoV起初被证实是人畜共患病毒,随后研究 发现,53%-60%的病例存在人与人之间的非持续传 播,并主要聚集在卫生保健机构内和家庭成员之间,后续研究表明,飞沫和环境接触都可导致病毒传播[86, 94, 95]。
4.3 症状和疾病
MERS-CoV感染的潜伏期约为5天(范围在2-15天), 94%的患者在第12天时出现疾病体征[16]。
MERS-CoV感染的典型的症状非特异性,临床表现包 括轻度/无症状感染、重度感染性肺炎、急性呼吸窘 迫、脓毒性休克和导致死亡的多器官功能衰竭等[11, 12]。同时,部分患者伴有ARDS和多器官功能障碍综合 征的呼吸衰竭,且多数出现并发症的患者需要在症 状出现后2-5天内入住重症监护病房。这些患者从症 状发作发展到需要采取有创通气和/或体外膜肺氧 合的中位时间为4.5-7天[16,34]。统计显示,严重疾病风 险较高的人群主要包括年龄在45岁以上并存在糖尿 病、肥胖症、慢性肾脏疾病、慢性心脏病和COPD等既 往病史的男性以及医护人员[11, 16]。
MERS爆发早期,病死率接近60%;随着疾病防范意 识和检测技术的提升,死亡率有所下降,但仍维持 在35%以上[96, 97]。与年轻患者相比,50岁以上患者的 死亡率更高(分别为77%和22%)[98],且男性患者和 有基础疾病的患者死亡率较高[16, 92]。
4.4 流行病学
自2012年9月以来,累计27个国家报告了MERS-CoV 的感染病例,包括意大利、荷兰、法国、德国、意大 利、突尼斯、马来西亚、英国、美国、伊朗、埃及、黎 巴嫩和土耳其等[97, 99]。初始病例限于中东地区和在 英国确诊的2例感染,后者为之前去沙特阿拉伯旅 行被感染患者的家庭成员。之后出现了群聚性感染(包括沙特阿拉伯的一次医院感染),从而证实病 毒在密切接触期间可在人与人之间传播[12, 100]。截 至2019年11月,各国已向WHO通报2494例经实验室检测确认的人感染病例和780例相关死亡(病死率 37.1%)[14]。然而,统计学研究指出,已发表的流行病 学数据仅反映有MERS临床表现的患者数量,但无 症状疾病的发生率更高。根据对2012年12月至2013 年12月期间被医疗专业人员接诊和参与疾病研 究个体的血清调查,估算沙特阿拉伯约45000人为 MERS-CoV血清学检测阳性[101]。此外,对2012年9月 至2016年前往受MERS影响国家的旅行者进行的一 项研究推测这些国家(沙特阿拉伯、阿拉伯联合酋 长国、约旦和卡塔尔)严重感染者达3300人,约为确 诊总数的2.3倍[102]。
2015年5月20日,韩国报告了首例确诊病例,出现了 沙特阿拉伯王国以外国家/地区最大规模的MERS- CoV疫情爆发。该首例确诊患者曾前往中东四个国 家,返回韩国时仍无症状。截至9月11日,已向WHO 通告了韩国的185例实验室确诊病例和36例死亡病 例,以及中国的一例病例[99]。
MERS感染的流行病学呈现出一定的季节性发病特 点,2013年、2014年和2015年春季的爆发时间与骆 驼分娩月份一致[96]。
MERS-CoV的基本再生数(R0)小于0.7―表明产生大 流行的可能性较低[12]。但相关研究人员仍建议,加强 疾病监测和对接触者的主动追踪,并彻底调查可能的动物宿主和人畜共患疾病再感染的途径,避免疫 情持续[12, 103]。
5. COVID-19
2019年底,武汉爆发了新型冠状病毒感染的肺炎 (COVID-19)[104,105]。测序显示,该疾病的病原体2019- nCoV为sarbecovirus亚属β冠状病毒,与SARS-CoV的 基因序列相似性为75%-80%[2-4]。据推测,蝙蝠可能 是其动物宿主,同时可能存在中间宿主[4]。WHO的风 险评估认为疫情在中国的情况为极高风险,在区域 和全球的情况为高风险[14, 27,106]。
6. 诊断
2002年SARS爆发初期,SARS的诊断主要基于临床 特征和阳性病例流行病学史[5]。临床特征显示,与 SARS相关的症状包括高热(>100.4°F/38°C)、咳嗽和 呼吸困难。如果有与肺炎或呼吸窘迫综合征相符的 浸润性病灶,可通过胸部X射线检查确诊。临床数据 显示,部分患者在出现症状2周内可检测到抗SARS 病毒抗体,发热3周后可获得明确诊断。
在SARS流行期间,FDA和CDC联合进行了SARS诊断 检测的验证和许可。诊断性检查的方法主要包括 血清学检测、细胞培养分离病毒、电子显微镜检查 和PCR检测。此外,Suresh,MR等人还研发了针对冠 状病毒抗体的ELISA检测法和免疫荧光血清学检测 法等,可用于SARS检测[107]。各类检测方法各具特色: (1)ELISA法的可靠性和特异性高,但需在症状出 现后约20天才可检出,无法满足快速诊断的需求 [107]; (2)免疫荧光检测法可在症状出现10天后在血清中检测到抗体,但需进一步排查。如症状出现4周 后血清检测为阴性,则排除SARS [108];(3)细胞培养 物中和电子显微镜检查在常规性诊断中存在灵敏 度不高、操作不便捷的局限性;(4)RT-PCR是唯一能 够用于早期临床检测的快速诊断方法,检出率为 37.5%-50%[107]。SARS爆发期间,多用两步常规和一 步定量RT-PCR进行检测[110],而实时RT-PCR可在病毒 滴度较低的疾病早期阶段进行检测[111]。
研究表明,SARS患者可检测出的病毒RNA量随感染 时间的推移不断增加,并在第10天左右达到峰值。 临床数据显示,感染后第一周的初始阶段,可在患 者的鼻咽抽吸物、咽拭子和痰液样本中检测到病 毒,而感染后期更容易在粪便样本中检测到病毒[109];部分患者在发病一个月后仍可从呼吸道分泌物 中检测出SARS-nCoV,但病毒较难分离培养。
MERS爆发期间,除上述SARS的检测方法外,还使用了蛋白质微阵列、微量血清中和试验以及蛋白质印迹等方法。结果显示,RT-PCR检测仍是所有方法中特异性和敏感性最高的方法[10,92]。2013年6月,美国FDA批准了CDC新型冠状病毒2012实时RT-PCR检测试剂盒的紧急使用许可,允许有资质的实验室将其用于检测呼吸道、血液和粪便样本检测。同期, WHO建议靶向upE基因筛查,并针对阳性样本进行ORF1a、ORF1b或N基因复检,同时建议使用从病毒载量最大的下呼吸道获得样本检测[92]。为减小创伤性取样的应用,有时也会用从上呼吸道采集的样本代替[16]。此外,德克萨斯大学和美国国立卫生研究院研发了针对MERS检测的不对称5引物逆转录环介导的等温扩增(RT-LAMP)技术,用于扩增位于ORF1a和ORF1b基因以及upE基因内的MERS-CoV基因组位点,并拟进一步开发便携式即时检验诊断试
除以上特异性检测方法外,冠状病毒的诊断方法还 包括鉴别诊断:(1)由肺炎链球菌、流感嗜血杆菌、 卡他莫拉菌、耐甲氧西林金黄色葡萄球菌和军团菌 等引起的肺炎,必须纳入SARS的鉴别诊断;(2)季节 性流感和禽流感、呼吸道合胞病毒感染、水痘带状 疱疹病毒感染、人偏肺病毒感染以及汉坦病感染等 发热性病毒感染也建议纳入鉴别诊断。此外,在适 当的情况下,还需考虑将其它流行性或影响人群较 广的疾病(如天花、土拉热病、炭疽、病毒性出血热 或鼠疫等)也纳入鉴别诊断[5]。
7. 预防
由于冠状病毒感染患者通常存在潜伏期(SARS 2-14天(平均4天)[5],MERS 2-15天(平均5天)[92]),且在潜伏期内往往无特异性症状,因此对于冠状病毒的感染预防工作往往需要政、医和科研界等多方配合。在尚无有效的抗感染药物或疫苗阶段,隔离、检疫和消毒等干预措施是控制具有大流行潜力的冠状 病毒感染的最有效手段[16, 113]。
政府应综合考虑防控带来的经济和社会影响,及时 采取防控措施。相关研究表明,政府采取积极的防 控措施对疫情控制有明显成效:新加坡实施有效的 SARS感染控制措施,将R0从第1周的7降至第2周的 <1[5];台湾实施A级检疫(疑似SARS患者的潜在暴露 接触者)减少了约461例新增病例和62例死亡病例; 相比之下,使用B级检疫(来自受疫区的旅行者)仅 使新增病例和新增死亡人数减少约5%[34, 114]。
在医护人员的防控方面,建议医护人员使用包括护 目镜在内的个人防护设备,以及外科口罩或一次性 N-95过滤呼吸器[16];同时,采取空气传播预防措施, 尤其在进行诸如插管等可能产生气溶胶的操作过程 [115];此外,应谨慎处理和运输所有疑似感染性标本, 必须在符合WHO BSL3标准的实验室进行检测[16]。
此外,用肥皂、酒精洗手对阻断病毒传播有一定效 果。相关数据显示:(1)SARS病毒能够在表面存活长 达6天,但使用漂白剂、75%乙醇、家用清洁剂[5]、化学 消毒剂(如聚维酮碘)或加热都可将其灭活[56];(2) MERS病毒在20°C下可存活长达48小时,在30°C下可 存活24小时[16]。
除上述措施外,作为人类预防病毒感染的重要方 法,疫苗具有重要意义。但疫苗的研发过程涉及病 毒株的分离、动物实验和临床试验等严格流程,需 要较长时间,截止目前,尚无已获批上市的针对冠 状病毒感染的有效疫苗。
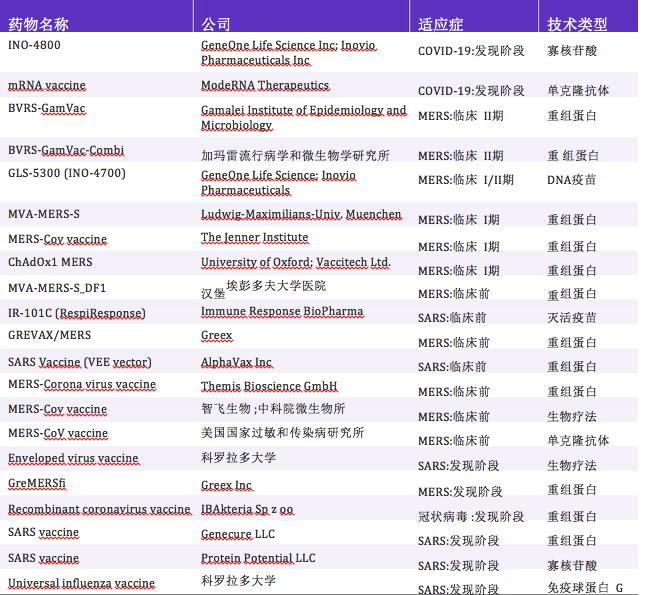
迄今为止,针对冠状病毒感染的在研疫苗共21种, 2种处于COVID-19的早期发现阶段(见表2)。研究显 示,S蛋白目前被认为是冠状病毒疫苗开发最有希望的靶点之一,并正被用于抗人冠状病毒疫苗的研发(如用于鼻内给药的黏膜疫苗,人类MERS-CoV疫苗(包括DNA疫苗、基于载体的减毒活疫苗和蛋白质亚单位疫 苗)[86,89,117-120]。
此外,研究发现腺病毒相关疫苗可诱导SARS-CoV特异 性T细胞和病毒中和抗体应答[121]。有研究指出,这两 种反应对持久性免疫保护非常重要:在对已治愈SARS 患者的长期研究中,抗体应答在大约6年后减弱,而T 细胞应答持续存在,表明后者是建立长期免疫所必需的[12]。在中东地区爆发MERS期间,相关人员还优先研 发了用于骆驼的疫苗,以阻断该疾病在人畜之间的传播[11,116]。
总体而言,近年来在冠状病毒引发的疫情期间,国际社会高度响应,多方配合密切,从前期的疫情防控过程中不断积累经验。WHO还专门针对SRAS疫情和MERS疫情的爆发修订了其成员国报告传染病的规则,有效提高了国际社会应对疫情爆发的反应速度和协作力度 [16,122]。
表 2 冠状病毒在研疫苗详情
8. 治疗
2003年SARS爆发期间,早期治疗方法主要为经验性[30]:治疗 (1)早期研究表明,来自人免疫血清球蛋白的广谱抗体治疗方法对SARS效果不明显,其他非特 异性免疫抑制剂或广谱抗病毒药物(如利巴韦林)[125,126]; 的治疗效果也相对有限 (2)临床试验显示,利巴韦林和皮质类固醇联合疗法被在一线治疗中取 得了一定效果。但该结果未在体外实验中获得证实[5, 127]; (3)为减轻副作用,部分治疗方案将皮质类固醇给药延迟到感染的第二周;(4)HIV蛋白酶抑制剂 洛匹那韦/利托那韦作为单药治疗或与利巴韦林联合使用可阻断SARS-CoV病毒的复制;(5)HIV蛋白酶 抑制剂奈非那韦被建议作为备选药物[30]。
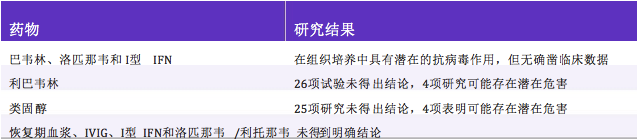
WHO对2002-2003年SARS爆发期间使用的所有已发 表药物治疗报告进行了总结(包括6类药物和72项 研究),结果显示,没有任何确凿证据表明针对SARS 患者有特效治疗药物(见表3)。相关人员指出,临床 试验的设计应考虑标准化方案(剂量和治疗时间 标),并持续监测临床数据[128]。同时,当疫情再次出 现,应在负压单人病房中隔离SARS感染的确诊患 者,并应使用合适的口罩尽量降低病毒通过呼吸道 分泌物传播的可能性[5]。
在MERS爆发后,美国国立卫生研究院筛选了290种 已批准并具有明确细胞靶点的试验药物,用以验证 其对SARS和/或MERS的疗效。结果显示,33种化合 物对MERS-CoV有活性,6种对SARS-CoV有活性,27种 对两种冠状病毒均有活性。活性药物分为13个治疗 类别,包括抗菌药和抗寄生虫药、神经递质抑制剂、 雌激素受体拮抗剂、激酶信号抑制剂、脂质或固醇 代谢抑制剂、蛋白加工抑制剂和DNA合成/修复抑 制剂[129]。在另一项研究中,荷兰研究者在一个由348 种FDA批准的药物组成的化合物库中筛选具有抗 MERS-CoV活性的药物,发现其中4种(氯喹、氯丙嗪、 洛哌丁胺和洛匹那韦)可在低微摩尔浓度下抑制 MERS-CoV复制,并建议在动物模型中进一步进行药 物评价。研究显示,MERS-CoV感染患者使用这些药物的过程中,即使不能100%有效阻断病毒复制,也 可以为患者的免疫系统争取对感染产生应答的窗 口期[130]。此外,有研究指出,洛匹那韦/利托那韦和 干扰素-β-1b联合使用在普通狨猴中产生了极好的 治疗效果,有进一步研究的价值[124]。
表 3 SARS感染药物治疗研究结果
8.1 皮质类固醇
皮质类固醇在SARS爆发期间被广泛使用。在一家中 国临床试验中心接受治疗的225例SARS患者中,使 用皮质类固醇使OI从平均237mmHg的基线值增加 到类固醇给药后的335mmHg,最佳剂量为1-3mg/kg(或160-240mg /d),总累积剂量为1000-2000mg,最 佳疗程为8-14天[131]。香港一家医院在治疗过程中发现,疾病早期阶段给药会延长病毒血症持续时间, 因此仅在SARS感染后期脉冲给药甲基泼尼松龙作 为抢救疗法[54]。
尽管糖皮质激素治疗对OI有积极影响[131],但回顾性 研究表明,该治疗方法的结局并不理想[128]。基于上 述经验,MERS患者在使用皮质类固醇进行治疗时 相对谨慎[2]。同时,建议在COVID-19患者的常规治疗 中尽量避免使用该类药物[1]。
8.2 广谱抗病毒药物
利巴韦林是一种核苷类似物,对某些冠状病毒以及 呼吸道合胞病毒和偏肺病毒具有活性。作为广谱抗 病毒药物,利巴韦林是首批用于抗SARS临床疗效检 测的化合物之一。早期研究表明,利巴韦林(或与皮 质类固醇联用)治疗SARS的效果差异较大[5]。其他 动物研究实验表明,在恒河猴的MERS-CoV感染模型 中,利巴韦林和IFN-a2b联用可减少病毒复制、调节 宿主反应、改善临床效果[132]。然而,对2012年10月至 2014年5月在沙特阿拉伯接受联合治疗的20例患者 进行的一项回顾性研究显示,尽管与标准治疗相比 利巴韦林/IFNα-2a联合治疗明显提高了患者的14天 生存率,但28天后的生存率无显著差异[133]。此外,利 巴韦林会带来大量副作用,包括剂量依赖性贫血、 心律不齐、胸痛和头晕等不良反应[5]。
除利巴韦林外,目前没有其他广谱抗病毒药物,这 与病毒缺少共同药物靶点有关。有研究表明,钙调 磷酸酶/NF-AT通路在CoV感染宿主的免疫细胞活化 中发挥重要作用,而环孢菌素的无免疫抑制活性的 衍生物有可能干扰这一过程,从而作为广谱冠状病 毒抑制剂发挥作用[134]。
8.3 病毒酶抑制剂
病毒酶抑制剂主要作用于冠状病毒复制的特定步骤,如:(1)进入抑制剂或膜融合抑制剂可阻断病毒 与宿主细胞的融合;(2)病毒蛋白酶抑制剂可阻断 聚合酶蛋白的裂解以抑制病毒RNA合成;(3)核苷类 抑制剂可特异性抑制病毒复制而不损伤宿主细胞; (4)丝氨酸蛋白酶靶向抑制剂可阻断病毒生命周期的后期过程。(5)许多宿主蛋白酶可对决定 [19, 136]; [19, 135] 病毒进入的S蛋白进行水解加工,包括组织蛋白酶、弗林蛋白酶和胰蛋白酶 (6)II型跨膜丝氨酸蛋白酶(TMPRSS2)等其他激活S蛋白的酶,也可视为 潜在靶点[19, 89]。;
药物试验结果显示,蛋白酶抑制剂和洛匹那韦/利托那韦联用在抗MERS-CoV方面取得了较大进展。其中,干扰素-β1b和洛匹那韦/利托那韦联合治疗的临床前评价取得成功(狨猴模型中的死亡率显著降低),并有待进一步的临床评价[16]。此外,正在进行的MIRACLE试验旨在评估洛匹那韦/利托那韦联合重组干扰素-β1b对MERS-CoV感染患者的有效性和 安全性[137]。
基于以上经验,武汉的医院对早期收治的COVID-19 患者进行了洛匹那韦和利托那韦联合治疗,同时迅 速启动了随机对照试验,以评价联合用药治疗这种 新型冠状病毒感染的有效性和安全性[1]。
此外,解旋、装配和胞吐等环节也被视为潜在的治 疗靶点,但目前仅在体外和动物模型中有效,尚未在人体中实验[11,138]。
8.4 干扰素
干扰素在SARS的体外试验和临床治疗中显示出一 定效果。
德国法兰克福大学医学院的研究人员评价了β-干扰 素、α-干扰素和γ-干扰素对来自法兰克福和香港患 者SARS-CoV菌株的抗病毒活性,并在Vero和Caco-2 细胞系中进行了复制[139]。结果显示,β-干扰素表现出良好的抗病毒活性,在两种细胞系中均可抑制SARS-CoV的复制;α-干扰素也具有一定活性,但敏感性指数是β-干扰素的/90―1/50;γ-干扰素在其中一 种细胞系的活性略高于α-干扰素,但在另一种细胞系中完全无活性[140]。体外研究中,MERS-CoV对α-干 [51] 扰素治疗的敏感性是SARS-CoV的50-100倍 。
加拿大研究人员研究了在多伦多一家医院联合使 用干扰素α-1和皮质类固醇治疗SARS疑似患者的 效果。该医院共9例患者接受了联合治疗,13例患者 接受了皮质类固醇治疗。结果显示:两种治疗方法 对发热和白细胞减少的效果相似,但联合治疗(分 别为33.3%和11.1%)组比单药治疗组(分别为38.5% 和23.1%)转入重症监护病房和需要插管的发生率 低,且联合治疗组无死亡,单药治疗组的死亡率为 7.7%。此外,联合治疗组患者的胸部X射线检查在4 天内转为正常,而单药治疗组为9天[141]。
2003年6月初,Amarillo Bioscience宣布在中国大陆 和台湾地区分发低剂量口服干扰素α锭剂,用于 SARS的潜在治疗和预防。前期动物实验表明,每日 一次口服小剂量干扰素α,持续四天,可显著降低感 染传染性胃肠炎冠状病毒(TGEV)的仔猪的死亡率。
此外,有研究表明,在19种被批准用于临床的抗病 毒药物中,Alferon N(干扰素α-n3)对SARS-CoV具有 较强的抗病毒活性[142]。
8.5 免疫调节剂
SARS期间,中国政府批准使用免疫系统增强剂进 行治疗,如赛生公司的日达仙(胸腺肽α1,在中国上 市,用于治疗乙型肝炎的免疫系统增强剂),虽未得 到有效数据支持,但仍被看作治疗SARS和其它感 染性疾病的潜在治疗药物[143]。有研究猜测,利巴韦 林可减少被感染小鼠体内促炎性细胞因子的释放, 作为免疫调节剂发挥作用[144],但体外研究表明,能 够抑制其它病毒的利巴韦林浓度不足以抑制SARS- CoV的复制[145]。因此,一些治疗成效可能归因于其 免疫调节活性[146]。
此外,在SARS流行期间,还使用了其他免疫调节的 治疗方案,如静脉注射免疫球蛋白和恢复期血浆[127, 147]。
MERS期间,部分韩国患者接受了恢复期血浆治疗。 一些医疗数据库和“灰色文献”描述了使用恢复期 血浆、血清或来源于恢复期血浆的高免疫球蛋白治 疗病毒引起的严重急性呼吸道感染,但回顾性分析 表明该方法安全,并有可能降低死亡率[147]。沙特阿 拉伯科学家报道称,由于合适供体的数量有限,评 价该疗法的临床试验将面临许多困难[148]。
8.6 单克隆抗体
单克隆抗体(MAbs)通常是防御新发疾病的一线技术。其中,免疫原性较低的全人源化抗体是首选种类[149]。
Dana-Farber癌症研究所分离出一种80R抗体,可阻 断病毒与ACE2受体结合,动物模型检测表明该抗体 可预防急性肺损伤,预期可以被动免疫的方式用于 SARS-CoV感染的早期治疗[5, 150]。随后的研究表明,该 抗体对另一种不同的SARS-CoV毒株无效[5]。
美国国家癌症研究所研究了两种新的抗体m396和S230.15,二者对ACE2受体的亲和力均>80R。建模 研究显示,两种抗体可中和SARS-CoV的毒株,推测其可能适用于未来SARS感染的诊断、预防和/或治疗[151]。
美国和中国研究人员的一项合作研究从候选抗体 中鉴定出三种MERS-CoV靶向受体结合域(CD26/ DPP4)的单克隆抗体,并进行了体外评价。结果显 示,MAb m336中和病毒的效价很高,有巨大潜力为候选治疗药物[152]。此外,日本研究人员还研究了 针对MERS-CoV CD26的单克隆抗体,并确定了人源 化MAb YS110作为候选药物的潜力,且进行了用于 其它适应症的临床试验[153]。
8.7 药物研发管线
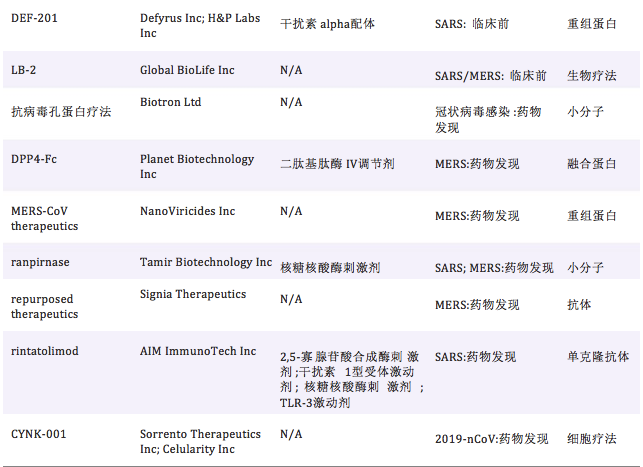
当前,针对冠状病毒的药物研发管线共23个,主要 涉及以上6种药物类型,详见表4。
表 4 当前抗冠状病毒药物研发管线
8.8 治疗靶点
当前,对冠状病毒的药物靶点研究持续进行,已验证的靶点主要集中于病毒脱壳、释放、复制、翻译、 组装、形成衣壳、出芽等步骤(见图2、图3)。

图 2 SARS-CoV感染靶点全景
注:箭头表示正效应;横线表示负效应。灰色或浅色符号是未经验证的蛋白质靶点(即,未处于活性开发阶段[UAD])。红色边框内的粉 红色文本框表示已验证的基因靶点。黄色文本框代表未验证的基因靶点。紫色和粉红色文本框分别表示细胞外和细胞内效应。绿色文 本框表示相关疾病/病况/症状。

图 3 MERS-CoV感染靶点全景
注:箭头表示正效应;横线表示负效应。灰色或浅色符号是未经验证的蛋白质靶点(即,未处于活性开发阶段)。红色边框内的粉红色文 本框表示已验证的基因靶点。黄色文本框代表未验证的基因靶点。紫色和粉红色文本框分别表示细胞外和细胞内效应。绿色文本框表 示相关疾病/病况/症状。






